各工作站、會員單位:
2011年啟動“優(yōu)質(zhì)道地藥材示范基地”至今,中國中藥協(xié)會中藥材種植養(yǎng)殖專業(yè)委員會(以下簡稱專業(yè)委員會)共評出69家企業(yè)54個品種85個“優(yōu)質(zhì)道地藥材示范基地”,為從源頭保障工商企業(yè)原料的穩(wěn)定優(yōu)質(zhì)供應(yīng)發(fā)揮了重要作用。
為充分落實《中華人民共和國中醫(yī)藥法》、《中醫(yī)藥發(fā)展戰(zhàn)略規(guī)劃綱要(2016-2030年)》、《中醫(yī)藥發(fā)展“十三五”規(guī)劃》、《“十三五”國家藥品安全規(guī)劃》和《中藥材保護和發(fā)展規(guī)劃(2015—2020年)》,著力推進中藥材資源優(yōu)勢轉(zhuǎn)化為產(chǎn)業(yè)優(yōu)勢,推動中藥材產(chǎn)業(yè)源頭與終端的產(chǎn)業(yè)對接和商業(yè)合作,加快中藥材生產(chǎn)的規(guī)范化、標(biāo)準(zhǔn)化、規(guī)模化與品牌化發(fā)展,專業(yè)委員會擬啟動2018年優(yōu)質(zhì)道地藥材示范基地評選工作,具體情況如下:
一、申報條件
(一)申報主體是具有獨立法人資質(zhì)的公司、合作社、農(nóng)(林)場;
(二)基地位于中藥材道地產(chǎn)區(qū),生態(tài)環(huán)境良好,具有一定的中藥材種植歷史(至少要有2個生產(chǎn)周期),并有藥材銷售;
(三)中藥材種植(養(yǎng)殖)相對集中,具有一定的規(guī)模,主要品種產(chǎn)量相對穩(wěn)定,在國內(nèi)有一定影響和知名度,具有品牌發(fā)展?jié)摿?
(四)申報單位規(guī)范生產(chǎn),質(zhì)量控制嚴(yán)格,具有健全的管理機構(gòu)和良好的服務(wù)機制,積極推進中藥材種植(養(yǎng)殖),建立相應(yīng)中藥材追溯系統(tǒng)和完善的生產(chǎn)質(zhì)量管理體系;
(五)申報單位與國內(nèi)外相關(guān)高校、科研機構(gòu)建立了穩(wěn)定的產(chǎn)學(xué)研合作關(guān)系;在中藥材種植、品種整理和選育、病蟲害防控、產(chǎn)地加工技術(shù)研究和示范推廣工作等方面有較好的基礎(chǔ);
(六)注重資源、環(huán)境保護,重視中藥材產(chǎn)業(yè)的可持續(xù)發(fā)展,符合《野生藥材資源保護管理條例》和《國家野生植物保護條例》等動植物保護法律法規(guī)和規(guī)定。
二、申報與認(rèn)定程序
(一)自薦申報、工作站推薦、其他協(xié)會推薦、政府推薦等方式。需提供以下資料:
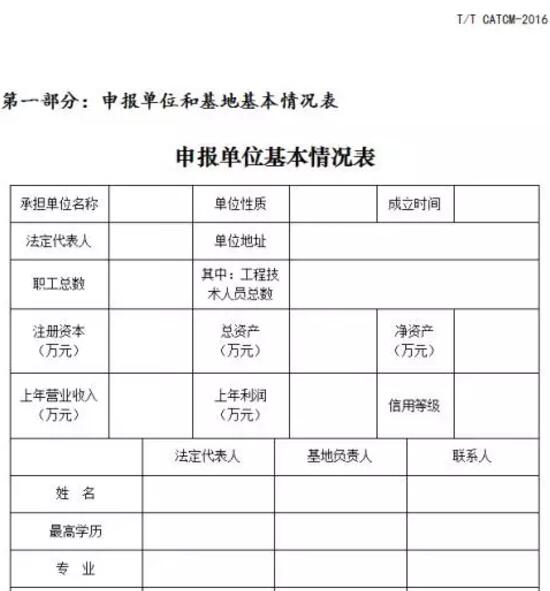
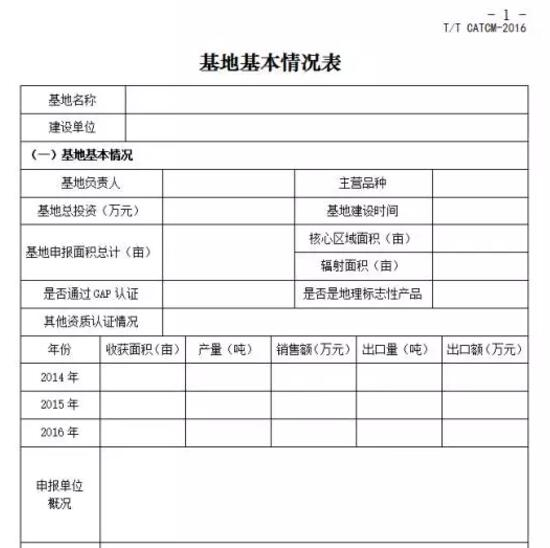
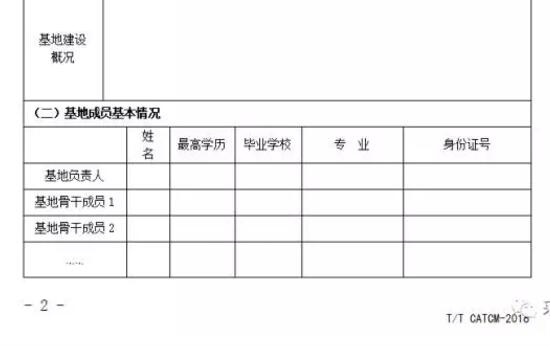
1.“優(yōu)質(zhì)道地藥材示范基地”認(rèn)證申請書,加蓋單位公章。認(rèn)證申請書參考專委會提供的模版進行撰寫,必須重點說明申報品種的種植歷史和規(guī)模、特定區(qū)域、基地規(guī)模、物種鑒定、質(zhì)量管理與控制、中藥材品質(zhì)等內(nèi)容。
2.中藥材申報單位資質(zhì)材料。
3.產(chǎn)地生態(tài)環(huán)境質(zhì)量證明材料:例如檢測報告(包括土壤、灌溉水、大氣環(huán)境等),設(shè)施農(nóng)業(yè)和菌類藥材,檢查設(shè)施內(nèi)環(huán)境(空氣、土壤、灌溉水)和生產(chǎn)用材(袋料、菌材等)。
4.中藥材生產(chǎn)管理、流程圖、質(zhì)量管理、制度及責(zé)任人等文件目錄。
(二)形式審查:優(yōu)質(zhì)道地藥材示范基地認(rèn)證工作小組在收到申報材料之日起10個工作日內(nèi),對申報單位的申報材料進行形式審查,提出形式審查意見。
(三)技術(shù)審查:通過形式審查后,將通過形式審查后的申報材料提交技術(shù)審查專家組進行技術(shù)審查。技術(shù)審查專家組在收到申報材料后30個工作日內(nèi)提出技術(shù)審查意見。
(四)現(xiàn)場核查:對于通過技術(shù)審查的申報基地,專業(yè)委員會將組織認(rèn)證評審專家組到申報單位和基地進行現(xiàn)場核查。對照優(yōu)質(zhì)道地藥材示范基地評分表,提出現(xiàn)場核查評價意見。
1.現(xiàn)場核查首次會議應(yīng)確認(rèn)檢查品種,落實檢查日程,聽取關(guān)于基地情況的匯報。
2.現(xiàn)場核查專家組在檢查過程中發(fā)現(xiàn)的缺陷項目如實記錄,必要時應(yīng)予取證,申報單位應(yīng)及時提供檢查所需的資料。
3.現(xiàn)場核查結(jié)束時,由現(xiàn)場核查專家組對檢查情況做出綜合評定意見,形成書面報告。
4.現(xiàn)場核查報告須現(xiàn)場核查專家組全體人員簽字,并附缺陷項目、專家檢查記錄、有異議問題的意見及相關(guān)證據(jù)資料。
5.現(xiàn)場核查末次會議應(yīng)現(xiàn)場宣布現(xiàn)場核查意見,申報單位有關(guān)人員對現(xiàn)場核查意見及檢查發(fā)現(xiàn)的缺陷項目有不同意見,可作適當(dāng)解釋、說明。現(xiàn)場核查專家組對申報單位提出的合理意見應(yīng)予考慮。
(五)合議終評:對通過現(xiàn)場核查的申報材料,專業(yè)委員會組織合議終評專家組根據(jù)技術(shù)審查、現(xiàn)場核查意見給出認(rèn)證結(jié)果。對經(jīng)現(xiàn)場核查不符合優(yōu)質(zhì)道地藥材示范基地認(rèn)證標(biāo)準(zhǔn)的,不予授牌。
(六)現(xiàn)場授牌:專業(yè)委員會定期組織行業(yè)專家、企業(yè)代表召開會議和論壇,對通過認(rèn)證的優(yōu)質(zhì)道地藥材示范基地現(xiàn)場授牌。
三、相關(guān)要求
1.各工作站、會員企業(yè)要高度重視,及時溝通協(xié)調(diào),共同做好申報工作,于2017年12月31日前上報相關(guān)申請書(電子版1份,審核通過后發(fā)紙版4份)。
若需電子版申報表格和文檔,請與曹海祿聯(lián)系。
2.各工作站要精心組織開展此項工作,認(rèn)真對照申報基本條件,對當(dāng)?shù)胤蠗l件并提出申請的單位進行摸排和遴選;各申報單位亦應(yīng)按照技術(shù)審查修改意見進行修訂,盡快反饋回。
3.秘書處:曹海祿,電話:13126695120,郵箱:caohailu@163.com
四、附件
.jpg)
.jpg)








